О времени и о себе
Академик Н. Семенов
Ученый должен всегда помнить, что ни чины, ни возраст, ни научные заслуги не должны иметь никакого значения в его научном общении с учениками, как бы молоды они ни были.
Нас часто упрекают, что тематика очень большого Института химической физики слишком разносторонняя, что институт занимается слишком многими проблемами. Но это лишь внешняя сторона. В научном смысле весь институт занимался и занимается одной научной проблемой — химической кинетикой. Из маленькой главы физической химии химическая кинетика за последние 40—45 лет превратилась в огромную область знания, которая применима не только к самым разнообразным химическим производствам, но и помогает другим отраслям науки и техники. Развитие всей химии, а теперь уже и многих разделов биологии невозможно без химической кинетики. С одной стороны, само развитие химической кинетики как науки требует того, чтобы мы занимались исследованием кинетических вопросов биологии. А с другой стороны, без этого не могла бы полноценно развиваться биохимия. Ибо сегодня уже мало познать строение клетки, зафиксировать процессы и стадии процессов, происходящих в ней, — надо уметь понять истинный кинетический механизм.Когда о нашем Институте химической физики говорят, что мы занимаемся полимерами, биохимией, ионосферой или еще чем-то иным, это неверно. Мы занимаемся кинетикой полимеризации, или кинетикой биохимических процессов, или кинетикой реакций в ионосфере. И это мы можем делать действительно хорошо, так как во всех этих случаях кинетические приемы еще далеко не так хорошо разработаны, чтобы их могли применять узкие специалисты в области полимеризации, биологии или ионосферы.
Но вернёмся к истории. В 1925 году мы занялись проблемой самовоспламенения газов, способных к горению и взрыву. С точки зрения химической кинетики эта проблема была почти совершенно не тронута. Во всяком случае, она никогда не была в центре научного внимания. Такое положение, вероятно, и определило наш быстрый успех. В течение 5—7 лет мы создали основы теории самовоспламенения и установили, что самовоспламенение бывает двух, и только двух, типов — тепловое самовоспламенение и цепное самовоспламенение, протекающее по законам разветвленных цепных реакций. Я думаю, что это является самым главным из того, что было сделано мною и моими ближайшими сотрудниками. Все последующие исследования у нас и за границей неизменно подтверждали сделанные тогда выводы не только качественно, но и количественно. И даже позднее, когда были открыты ядерные взрывы, оказалось, что они тоже подразделяются на два этих типа: на термоядерные и на разветвленно-цепные. Формально и здесь теории оказались близкими.
Тепловое самовоспламенение является следствием выделения тепла при экзотермических реакциях и возникновения тепловой лавины: выделяющееся тепло приводит к повышению температуры газа, последняя увеличивает скорость реакции, это, в свою очередь, ведёт к увеличению выделения тепла и снова к дальнейшему повышению температуры.
В тепловом взрыве источником выделения тепла является химическая реакция, скорость которой очень быстро растет с увеличением температуры. Унос тепла от горючего газа к стенкам реакционного сосуда осуществляется теплопроводностью и, таким образом, линейно зависит от разности температур газа и стенки. Математически этот процесс характеризуется некоторым критерием, включающим начальную температуру камеры, давление газа, кинетические постоянные скорости реакции и тепловые константы вещества. Если этот критерий меньше единицы, то наступает тепловое равновесие — теплоприход компенсируется теплоотводом. Если этот критерий больше единицы, то равновесие невозможно: тепловая лавина сначала медленно, а потом очень быстро нарастает — и происходит взрыв. Теория теплового взрыва была подвергнута многократной экспериментальной проверке и у нас и за границей и в конце 30-х годов получила общее признание.
Следует отметить, что до середины 20-х годов проблемы самовоспламенения так же, как и вопросы распространения пламени, разрабатывались взрывниками, теплотехниками и частично физиками и механиками. Эти проблемы со времен Ван-Гоффа мало интересовали физико-химиков. Химическая кинетика, как правило, не учитывалась при решении проблем горения. Вместо нее вводилось понятие температуры самовоспламенения как некой константы каждого горючего вещества. Мы же показали, что температура самовоспламенения отнюдь не является константой вещества. В наших работах в основу явления горения была положена химическая кинетика, осложненная выделением тепла и наличием обратной связи между ростом температур и ходом реакции. Это был первый случай изучения более широкого класса явлений, ныне называемого макрокинетикой. Именно на этой основе удалось в дальнейшем превратить не только теорию самовоспламенения, но и теорию различных видов распространения пламени в одну из глав химической кинетики.
Второй тип самовоспламенения — это самовоспламенение цепное. Оно также является следствием выделения энергии при химических реакциях, но не в виде тепла, а еще до того, как эта энергия превращается в тепло. Эта выделяющаяся энергия вызывает «размножение» химически весьма активных свободных атомов, радикалов и электронно-возбужденных частиц и приводит к развитию так называемой цепной лавины. В этом случае разогрев газа является следствием, а не причиной самовоспламенения. В основе закономерностей этого процесса лежит введенное нами представление о разветвленных цепных реакциях. Вскоре после нашей первой работы Хиншельвуд изучил явление верхнего предела самовоспламенения и показал, что оно также объясняется разветвленным характером цепной реакции.
В 1925—1926 годах Ю. Б. Харитоном и мной были обнаружены критические явления цепного воспламенения на примере окисления паров фосфора. Воспламенение происходило лишь в тех случаях, когда давление паров в сосуде достигало определенного критического значения — нижнего предела. Этот предел оказался зависящим от количества разбавляющего пары фосфора инертного газа, от размеров сосуда, от количества различных примесей. Возможность теплового воспламенения была здесь исключена: когда давление было ниже этого предела, в течение многих суток не было вообще никакой реакции, а едва давление становилось чуть выше предела, реакция заканчивалась в течение долей секунды. Кроме того, при низких давлениях температуропроводность так велика, что реакция протекала практически при постоянных температурах. Впоследствии подобные же явления нижнего предела были открыты и у нас в стране и за границей применительно ко многим окислительным реакциям — например, недавно у нас в Институте химической физики оно было обнаружено для реакций фторирования. Тогда же, в 1925—1926 годах, это удивительное явление было объяснено нами путем введения понятия о разветвленных цепных реакциях.
Как известно, неразветвленные цепные реакции были открыты в 1913 году немецким химиком Боденштейном на примере фотохимического образования хлористого водорода. Молекула хлора, поглощая квант света, диссоциирует на атомы. Атомы же хлора, будучи очень активными частицами, ведут цепь превращений без участия света: они реагируют с молекулами водорода, давая хлористый водород и активный атом водорода; атом водорода, быстро реагируя с молекулой хлора, также образует хлористый водород и регенерирует новый атом хлора. Так этот процесс продолжается до тех пор, пока атом хлора не исчезнет в результате рекомбинации или захвата какой-либо примесью. Мы добавили к этому объяснению лишь представление о возможности гибели свободных радикалов или атомов в результате захвата их стенкой сосуда (этот вид обрыва цепи делается основным при пониженных давлениях, когда диффузия к стенкам идет достаточно быстро) и доказали это прямыми опытами.
Поскольку длина неразветвленной цепи плавно растет с увеличением давления и температуры, цепи этого вида не могли объяснить наблюдаемых в опытах с парами фосфора критических явлений. Вот здесь-то мы и ввели представление о разветвленных цепных реакциях, которые сегодня общеизвестны. В неразветвленной цепной реакции радикал первого вида, взаимодействуя с молекулой исходного вещества, родит радикал второго вида и молекулу конечного продукта (схема вверху). Затем радикал второго вида родит новый радикал первого вида, и так происходит до тех пор, пока радикал не исчезнет в результате обрыва цепи. Скорость реакции при этом будет определяться скоростью зарождения активных частиц, умноженной на длину цепи, или, иными словами, числом получающихся на один первичный радикал молекул продукта.
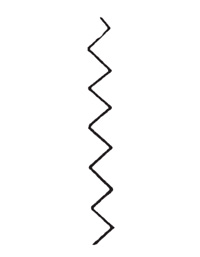
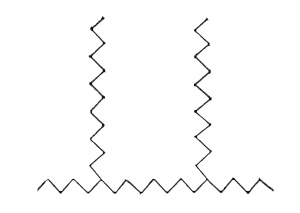
Однако при протекании экзотермических реакций возможны случаи, когда, например, в ходе реакции вещества с радикалом второго вида, помимо восстановления радикала первого вида, возникают дополнительно еще два радикала того же второго вида и их число становится равным трем (схема на стр. 25 вверху). Подобное разветвление цепи реакции может происходить либо эпизодически, либо на каждом шагу реакции (сплошь разветвленные цепи, схема на стр. 25 внизу). В обоих этих случаях достаточно появиться одному-единственному радикалу, чтобы началось размножение радикалов, а следовательно, лавинообразное ускорение реакции во времени. Этот процесс будет продолжаться до тех пор, пока вся химическая система не начнет реагировать столь быстро, что реакция закончится в течение очень малого времени, или, иными словами, произойдет цепное самовоспламенение.
Однако такое размножение радикалов возможно лишь в том случае, когда скорость возникновения разветвлений превосходит скорость гибели радикалов на стенках сосуда или при захвате их некоторыми примесями. Когда же скорость возникновения разветвлений делается меньше скорости гибели радикалов, то цепная лавина родиться не может. Поскольку число первичных радикалов, зарождающихся в результате теплового движения при невысоких температурах ничтожно мало, скорость такой реакции оказывается практически равной нулю. Изменяя условия обрыва цепи — давление, плотность, температуру, размеры сосуда, количества добавленных примесей, захватывающих радикалы, — мы переходим от условий практически полной инертности вещества к быстрому процессу воспламенения. В этом и заключается разгадка предельных явлений.
Как показали физики, явление атомного взрыва по своей физической сущности совершенно отлично от химических цепных реакций. Но по формальным закономерностям эти реакции оказались почти идентичными химическим разветвленным цепным реакциям. В случае атомных цепных реакций нейтрон, сталкиваясь с ядром, создает возбужденное ядро, которое делится с испусканием уже трех нейтронов, и в результате идет сплошь разветвленная цепная атомная реакция. Однако нейтроны в той или иной степени исчезают как в результате выхода из активного вещества наружу, так и из-за поглощающих их примесей каких-либо атомов. Поэтому и здесь имеют место типичные предельные явления перехода от полной инертности вещества к атомному взрыву. Таким образом, и здесь существуют критические параметры, что, в сущности, и делает возможным существование атомных бомб и атомных котлов. Мы пока не можем говорить о том, что в каком-то новом своеобразном виде разветвленные цепные реакции существуют в биологии, но по крайней мере в некоторых случаях и здесь наблюдаются явления прогрессивного (хотя и медленного) автоускорения таких процессов.
Представление о разветвлении цепей оказалось очень плодотворным не только для вопросов цепного воспламенения и распространения пламени, но и для установления механизма медленных процессов окисления углеводородов и других реакций, обнаруживающих автоускоряющийся характер. В последних случаях мы имеем дело с вырожденными или запаздывающими разветвлениями, которые вызываются образованием промежуточных продуктов, менее активных, чем атомы и радикалы, но все же более активных, чем исходные вещества. Введенные нами понятия о вырожденных разветвлениях вызвали широкий резонанс, и механизм этих реакций стал широко обсуждаться. Основополагающие работы по механизму этих реакций были сделаны профессором Норришем. Закономерности протекания вырожденного взрыва имели большое значение для понимания процессов горения в двигателях и химических реакций в жидкой фазе.
Работы по разветвленным цепным реакциям имели большое значение и в другом отношении. Они показали физико-химикам, сколь сложным путем могут протекать даже такие простые реакции, как образование воды из водорода и кислорода, и к каким удивительным новым явлениям приводят эти своеобразные реакции. Все это разрушало установившиеся классические представления о том, что простые моно- и бимолекулярные реакции являются основным видом химического превращения. На самом деле большинство химических реакций протекает сложным путем. Отсюда возник огромный интерес к изучению не только разветвленных, но и неразветвленных цепных, чисто радикальных и вообще сложных реакций, к развитию методов фиксации свободных радикалов, атомов и других активных частиц, к изучению механизма протекания каждого элементарного акта реакции, к определению констант этих элементарных актов.
Здание химической кинетики, воздвигаемое учеными всего мира, становится все более величественным. Во все возрастающем масштабе новая химическая кинетика получает практическое применение.
Статьи по теме
- ТЕОРИЯ ЦЕПНЫХ РЕАКЦИЙ (Из статьи "Теория горения", "Наука и жизнь" №8-9, 1940 г.)
- Цепная реакция
- В кадре — академик Н. Н. Семёнов…
- Разделить по массе
Читайте в любое время

