Как противовирусный белок защищает от рака
Дефекты в ДНК запускают против злокачественной клетки механизм, который здоровые клетки используют против некоторых вирусов.
На днях мы уже говорили о том, что делает клетка, когда внутри неё появляется вирус: специальные рецепторы, чувствующие вирусную ДНК или РНК, подают сигнал тревоги, включая систему врождённого иммунитета. Эти рецепторы относятся к группе так называемых толл-подобных рецепторов, но они не единственные, кто сигнализирует об инфекции. Специально против ДНК-содержащих вирусов (таких как вирусы герпеса или оспы) в наших клетках есть фермент cGAS. При заражении вирусная ДНК появляется в цитоплазме, где с ней связывается cGAS. Связавшись с ДНК, он создаёт сигнальную молекулу, которая активирует иммунные сигнальные пути: в клетке начинают синтезироваться интерфероны и другие белки, которые стимулируют воспаление и сообщают наружу, что клетка больна.
Но cGAS включается не только при вирусной инфекции, но и при перерождении клетки в злокачественную. ДНК в цитоплазме вообще быть не должно, если она появилась, значит, что-то не в порядке, и вот как раз в опухолевых клетках куски ДНК часто выходят за пределы ядра. И задача cGAS здесь та же – привлечь внимание иммунитета к больной клетке, чтобы иммунитет её уничтожил вместе с болезнью. Однако cGAS-сигнал тут срабатывает иначе.
Какое-то время назад cGAS обнаружили в ядре, что выглядело совсем странно: в ядре полно ДНК, и cGAS должен был бы запустить сигнал о болезни на полную мощность. Но ничего такого не происходит, то есть cGAS, вероятно, как-то блокируют. Действительно, он взаимодействует с белками-упаковщиками ДНК, которые помогают длиннейшим нитям ДНК компактно уложиться в ядре. cGAS взаимодействует с ядерной ДНК, но он также взаимодействует и с этими белками-упаковщиками, и пока он с ними взаимодействует, он неактивен.
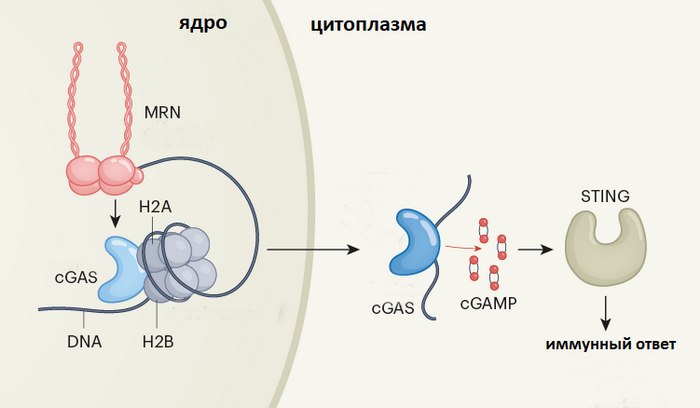
В ядре белок cGAS связывается с ДНК, но его активации мешают белки-упаковщики (гистоны H2A и H2B). MRN-комплекс, который ищет двойные разрывы в ДНК, освобождает ядерный cGAS, который уходит в цитоплазму, связывается здесь с ошмётками ДНК, и с помощью сигнальной молекулы cGAMP активирует белок STING, а уже STING включает разнообразные иммунные сигналы. Иллюстрация: Nature (с изменениями).
Активирует его сложный белковый комплекс MRN. Задача MRN – искать двуцепочечные разрывы в ДНК. Найдя разорванную цепь, MRN с помощью цепочки сигналов включает другие белки, которые ремонтируют ДНК и которые управляют клеточным циклом (с разорванной ДНК клетке лучше пока не делиться). И ещё комплекс MRN активирует cGAS, помогая ему освободиться от белков-упаковщиков. Сотрудники Университета Северной Каролины в Чапел-Хилле описывают всю последовательность событий в Nature: разрывы в ДНК привлекают детектор разрывов MRN, тот выбивает cGAS из, так сказать, объятий белков-упаковщиков – а дальше cGAS каким-то образом (пока непонятно, каким) выходит в цитоплазму. Здесь он видит куски ДНК, которые тоже пришли сюда из ядра. Дело в том, что у злокачественных клеток системы репарации (ремонта) ДНК часто испорчены, мутированы, поэтому ДНК остаётся фрагментированной – и вот эти-то фрагменты и выходят в цитоплазму. Тут их видит cGAS, который понуждает больную клетку сообщить о своей болезни иммунитету.
Весь механизм срабатывает, только если в ДНК появляется много разрывов, как это часто бывает в раковых клетках. Вероятно, к вышедшим из ядра молекулам cGAS присоединяются и те, которые изначально плавали в цитоплазме, но подробности молекулярных взаимоотношений между разными группами cGAS ещё предстоит выяснять.
Исследователи экспериментировали с опухолью молочной железы у мышей – как известно, у этого рака мутированы гены BRCA1 и BRCA2, кодирующие белки из системы ДНК-репарации. Когда активность MRN-комплекса подавляли, злокачественные клетки спокойно делились и опухоль быстро росла. Но если через MRN активировали cGAS и дальнейший иммунный ответ, клетки начинали делиться медленнее, а то и вовсе переставали, постепенно дряхлея и погибая. Возможно, для этого молекулярно-клеточного механизма подберут стимулирующие лекарства, которые повысят эффективность лекарственных и иммунологических терапий, по крайней мере, против некоторых видов рака.
18 января 2024
Статьи по теме:
