Синапсы мозга рассмотрели в расширении
Если кусочек нервной ткани надуть гидрогелем, можно увидеть молекулярные отличия нейронов и синапсов.
В последнее время один за другим появляются клеточные карты, или атласы, для самых разных тканей и органов – методы «одноклеточной биологии» позволяют описать местоположение одной-единственной клетки с учётом её внешнего и внутреннего строения, белкового состава, активности генов и т. д. При этом есть один орган, который упорно сопротивляется картированию по клеткам. Речь, конечно, о мозге.
Проблема в самом устройстве нейронов и нейронных цепей: отростки нервных клеток могут идти очень далеко, буквально через весь мозг, и каждый отросток нужно тщательно проследить, не путая его с отростками других клеток. И мало просто проследить путь аксона или дендрита, нужно ещё описать все его синапсы, то есть межнейронные соединения, благодаря которым собственно, работают и нейронные цепи, и мозг в целом. Синапсов много и они разные – они используются для разных задач, в них работают разные нейромедиаторы и регуляторные соединения, и в целом их молекулярный портрет может быть с теми или иными особенностями.
Успехи в построении карты нейронной карты мозга одновременно и очень значительные, и весьма скромные. Для человеческого мозга с более чем 80 млрд нейронов и 100 трлн синапсов это пока что неподъёмная задача. Пока что самое крупное достижение тут – мозг дрозофилы: мы писали в прошлом году, что для него удалось построить атлас со 140 тысячью нейронов и 54,5 миллионами синапсов.
У млекопитающих пока удаётся картировать только очень маленькие кусочки. Так, месяц назад в журналах Nature и Nature Methods вышло восемь статей с описанием 1 мм3 зрительной коры мыши, причём атлас кусочка мышиного мозга строили с учётом активности живых нейронов. Главную роль в подобных исследованиях играет электронный микроскоп: образец мозга нарезается тысячи и десятки тысяч сверхтонких слоёв, которые отправляются на электронную микроскопию; полученные петабайты изображений объединяют в трёхмерную карту. В этой работе активно задействован искусственный интеллект, после которого потом ещё выискивают возможные ошибки. Но, как бы то ни было, электронный микроскоп не позволяет увидеть молекулярные особенности синапсов. Их можно увидеть, если пометить белки разными флуоресцентными метками и в микроскопе наблюдать их свечение. Однако тут возникает другая проблема: флуоресцентная микроскопия сильно уступает в разрешении электронной, и в ней просто невозможно различить свечение разных флуоресцентных меток, которые расположены слишком близко друг к другу.
Сотрудники Научно-технического института Австрии решили эту проблему с помощью метода, который впервые был описан около десяти лет назад. В ткань вводят гель, который фиксирует положение белков и клеточных структур, с которыми они связаны. Гель способен впитывать воду и разбухать. Биологическую ткань с гидрогелем смачивают специальным раствором, и гель, увеличиваясь сам, увеличивает и те структуры, на которые раньше не хватало разрешающей способности – теперь их можно обработать флуоресцентными метками и анализировать с помощью флуоресцентного микроскопа. При расширении, конечно, что-то разрушается, но связанные с гелем белки сохраняют положение друг относительно друга. То есть белок, который находится, например, в клеточном ядре, не переместится туда, где должна быть наружная мембрана. Форма и расположение молекулярных комплексов и клеточных структур более-менее сохраняется.
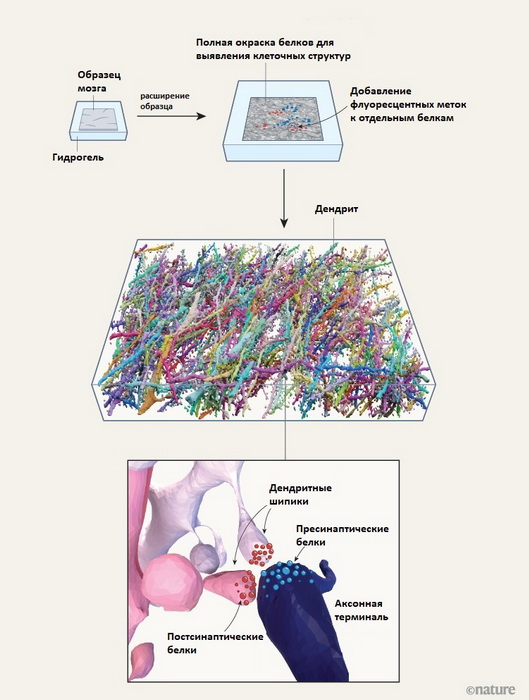
Схема картирования нейронов и синапсов с помощью гидрогелевого расширения. Дендритные шипики – выпячивания на мембране дендритов, готовые сформировать синапс. Аксонная терминаль – концевой участок аксона, участвующий в синапсе. (Иллюстрация: Tavakoli, Lyudchik et al., Nature, 2025)
В данном случае метод приспособили к тому, чтобы с его помощью описать с максимальной полнотой синапсы в образце мозга. Образец подвергали расширению дважды, так что он увеличивается в 16 раз; меченые белки сохраняли интенсивность свечения, несмотря на разбегание друг от друга. Микроскоп ловил свечение от флуоресцентных меток, последовательно сканируя весь образец. Здесь тоже получается набор картинок (точнее, оптических данных), которые нужно составить в трёхмерную карту. Но, как было сказано, с искусственным интеллектом эта задача стала намного проще; более того, обучающиеся алгоритмы, которые помогали делать карту мозга дрозофилы из данных электронного микроскопа, можно использовать и с материалом флуоресцентной микроскопии с расширяющимися образцами.
В результате структурная карта нейронов синапсов дополняется молекулярными подробностями, причём, что важно, молекулярные подробности мы получаем одновременно со структурными. Когда мы смотрим на картинки, полученные после электронного микроскопа, то обычно видим там разноцветные нейроны, но надо понимать, что разноцветность там появилась потом, когда картинку обрабатывали и делали более удобной и понятной. Разноцветность нейронов и синапсов во флуоресцентной микроскопии видна сразу – она показывает расположение разных белков с соответствующими метками (хотя, конечно, и флуоресцентные данные потом тоже проходят обработку, когда из них лепят 3D-карту).
Исследователи работали с образцом мышиного мозга размером 4,2 мм3 – таким он стал после гидрогелевого расширения. Вряд ли так можно поступить с целым мозгом, а значит, его всё равно придётся нарезать на части и потом соединять получающиеся кусочки карты, и тут возможны более или менее существенные потери и искажения в общей картине. Впрочем, даже в масштабе отдельных небольших фрагментов этот метод может дать массу полезной информации о том, как устроены нейроны и их синапсы.
Результаты исследований описаны в Nature.
11 мая 2025
Статьи по теме:
