Na
11
22.9898
Натрий
Помогает клеткам жить и охлаждает атомные реакторы.
Крупинки «натрий-хлора» в солонке, бензоат в газировке и лаурилсульфат в шампуне – натрий окружает нас если уж не повсюду, то, по крайней мере, на кухне и ванне. Даже внутри нашего организма клетки тратят огромные ресурсы на поддержание баланса натрия и калия, нарушение которого очень опасно для здоровья. Но это всё – натрий, входящий в состав химических соединений, а совсем не тот кусок мягкого металла, с помощью которого некоторые пытливые экспериментаторы проверяют прочность сантехнических конструкций. Хотя это далеко не единственное его применение: расплавленный натрий используется как теплоноситель для охлаждения атомного реактора, а это уже, согласитесь, совсем игрушки. Но где ещё можно найти натрий? Открываем наш журнал!

Кристаллы «обычной» соли или хлорида натрия. Фото: Rob/Flickr.com CC BY-NC-ND 2.0
Начнём с самого близкого нам во всех смысла натрия, баланс которого так тщательно контролируют наши клетки, и на это у них есть вполне весомые причины. О том, что в живых организмах электрические явления играют не последнюю роль, учёные плотно задумались уже после знаменитых экспериментов Луиджи Гальвани над лягушками. Поскольку в живых и даже уже неживых организмах, коими стали несчастные земноводные у Гальвани, отсутствовали металлические провода, то стало ясно, что и процессы в них чем-то отличаются от обычных электрических явлений. Шаг за шагом к началу двадцатого века исследователи выяснили, что главную «электрическую» функцию в клетке выполняет её оболочка – мембрана, а электрические явления имеют химическую природу, связанную с движением ионов сквозь неё.

Монумент Луиджи Гальвани в Болонье, Италия. Фото: Michele Ursino/Flickr.com CC BY-SA 2.0
Ионы сквозь мембрану могут проникать только по специально предназначенным для этого проходам – ионным каналам. Конечно, можно представить, что каналы - это своего рода трубы, по которым внутрь или наружу клетки двигаются ионы. Но тогда становится непонятно, как клетка может поддерживать внутри себя высокую концентрацию ионов калия и низкую концентрацию ионов натрия – тот самый натрий-калиевый баланс. Ведь если внутрь клетки по каналу может пройти большой ион калия, тогда вслед за ним с лёгкостью бы прошёл маленький натрий, и не было бы никакого баланса. Но, несмотря на это, мы с вами отлично существуем, а значит, клетки как-то умеют отличать калий от натрия и делают это явно не по размеру. Проблема настолько волновала учёный мир, что за открытие структуры ионных каналов в 1997 году была присуждена Нобелевская премия.
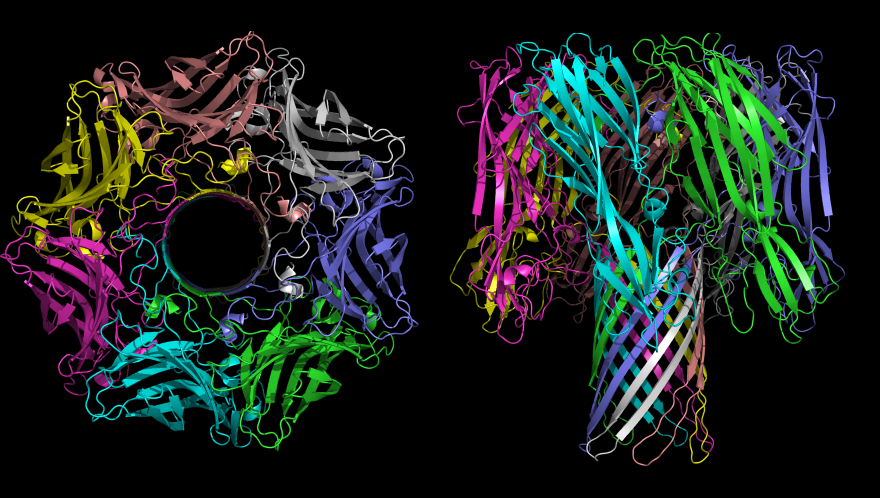
Структура альфа-гемолизина – токсина, выделяемого золотистым стафилококком. Встраиваясь в мембрану, этот белок создаёт канал, по которому ионы натрия и калия начинают бесконтрольно перемещаться, нарушая нормальную работу клетки. Фото: Bassophile/Wikimedia Commons CC BY-SA 3.0
Оказалось, что на внутренних стенках канала на строго определённых местах находятся атомы кислорода, имитирующие молекулы воды вокруг иона. В результате ион, попадая внутрь такого канала, чувствует себя как дома, точнее, как в растворе. Дело в том, что в растворе разные ионы имеют разную оболочку из молекул воды, и даже у таких похожих ионов, как натрий и калий, водяная «шуба» чуть-чуть, да отличается. Поэтому натрий, попав внутрь канала, предназначенного для калия, чувствует себя в нём неуютно и возвращается туда, откуда пришёл. Подобный принцип реализован в особом виде ионных каналов: натрий-калиевых насосах. Это специальные встроенные в мембрану белки, которые поочерёдно выпускают из клетки ионы натрия, а внутрь запускают ионы калия. Правда, для этого им приходится каждый раз перестраивать структуру канала.
От натрия, который есть в нас самих, перейдём к натрию, который мы едим. Разумеется, никто не готовит себе десерт из мелко нарезанных ломтиков металлического натрия – в наш организм он поступает в виде соединений с другими элементами и веществами. Например, в виде обычной поваренной соли, которая есть не что иное, как хлорид натрия. Кстати говоря, такой соли нашему организму нужно не больше пяти граммов в день, а всё что выше, идёт уже во вред, приводя к проблемам с давлением.

Кристаллы хлорида натрия, выращенные на Международной космической станции. Фото: Nasa/Flickr.com CC BY-NC 2.0
Название другого интересного вещества – бензоат натрия часто можно встретить в составе пищевых продуктов с пометкой «консервант». Оно относительно безвредно для человека, но весьма эффективно подавляет рост микроорганизмов, благодаря чему пища может храниться дольше. Ещё у бензоата натрия есть весьма интересная особенность: разные люди по-разному воспринимают вкус этого вещества. Для кого-то оно сладкое, кому-то кажется солёным, а кто-то чувствует горечь, причём зависит это от генов конкретного человека. Поговаривают, что один химик любил предложить своим гостям стакан воды, куда он предварительно добавил чуть-чуть бензоата натрия, и попробовать определить, какого она вкуса. Как результат, в большинстве случаев споры об «истинном» вкусе надолго занимали гостей. Эксперимент вполне в стиле самого известного научного «тролля» Роберта Вуда. Шутки – шутками, а сейчас продаются тестовые полоски с бензоатом натрия, для определения генетических различий между людьми.

Тест-полоски с бензоатом натрия. Фото: Jhayne/Flickr.com CC BY-NC-SA 2.0
Помимо бензоата, натрий входит в состав двух других популярных консервантов: нитрита натрия и бисульфита натрия. Только нужно сразу оговориться – антимикробное действие оказывает не катион натрия, а вторая «половинка» соли: анион бензойной (бензоат), азотистой (нитрит) или сернистой (бисульфит) кислоты. Натрий же выбран как самый безвредный компонент для этих соединений. Кстати, совсем не обязательно использовать консервант в виде соли, можно, например, растворить в жидкости диоксид серы – так поступают при изготовлении вина ещё со времён Древнего Рима. Однако у этого метода есть один неприятный во всех смыслах эффект: такое вино со временем может приобрести неприятный запах сероводорода. Позволим себе ещё небольшую ремарку по поводу консервантов. Может показаться, что еда без «химии» и консервантов – это полезно и «экологично». Что же, в этом действительно есть своя правда. Но если на другую чашу весов мы положим ту массу продуктов, которая испортится и будет выброшена, если мы перестанем использовать консерванты, и взвесим те ресурсы, которые потребуются, чтобы эти продукты произвести, то очень может получится, что польза от «химии» с лихвой перекроет её вред.

Сельскохозяйственные поля в округе Дэлавер, штат Огайо. Фото: Caribb/Flickr.com CC BY-NC-ND 2.0
От биохимии и еды плавно перейдём к более «химическим» сферам, где мы встретили натрий. Почему плавно? Потому что просто невозможно не рассказать о таком соединении как хлорат натрия и том, как безответственно его применяли новозеландские животноводы в начале прошлого века. Фермеры из страны бескрайних лугов столкнулись с двумя проблемами: сначала их знаменитые коровы начали болеть и умирать, а после того как первая проблема была решена, некоторые владельцы пастбищ столкнулись с другой напастью – их одежда стала неожиданным образом самовоспламеняться.

Пастбище в Новой Зеландии. Фото: Trey Ratcliff/Flickr.com CC BY-NC-SA 2.0
Падёж скота был вызван растением с названием крестовник луговой, которое было занесено в Новую Зеландию в конце девятнадцатого века, и, как это случается с некоторыми инвазивными видами, слишком успешно прижилось на местных лугах. Всё бы ничего, но в этом растении содержатся токсичные алкалоиды, от которых собственно и гибли бурёнки. Наступление крестовника стало настоящим бедствием для фермеров, которые были вынуждены бросать немалые силы на уничтожение этого ядовитого сорняка: на прополку полей выходили все от мала до велика. Поэтому новость о том, что появилось химическое вещество, от которого крестовник вянет и сохнет, было воспринято с крайним воодушевлением.
Видимо крестовник настолько замучил новозеландских фермеров, что они излишне активно принялись поливать луга и пастбища раствором хлората натрия. Вот тут-то и появилась неожиданная проблема со штанами. Оказалось, что пропитанная хлоратом натрия одежда рабочих через некоторое время становилась взрывоопасной, причём от этого не спасала даже стирка. Кстати, проверку реальности «взрывающихся штанов» проводили в одной из серий популярного телешоу «Разрушители мифов» – штаны действительно взрываются!

Крестовник луговой или якобея обыкновенная (Jacobaea vulgaris). В Новой Зеландии растение было внесено в список запрещённых к распространению Фото: Steve Chilton/Flickr.com CC BY-NC-ND 2.0
Пока что мы говорили о натрии как об элементе, который входит в состав других химических веществ или плавает в виде ионов в растворе. А как обстоят дела с тем самым «настоящим» металлическим натрием, который эффектно взрывается, если его бросить в воду? Металлический натрий нашёл неожиданное применение в атомной энергетике – его используют в качестве теплоносителя для охлаждения реактора. Если говорить о теплоносителях, то в «обычной» жизни мы можем столкнуться разве что с водой в батареях центрального отопления или антифризом из этиленгликоля в системе охлаждения двигателя автомобиля. Представить, что нужно расплавить металл и прокачивать его по трубам для, того чтобы что-то охладить, может далеко не каждый. Тем не менее, когда нужно отвести тепло от атомного реактора, использовать жидкий натрий – отличная идея, и вот почему. Во-первых, жидкий натрий хорошо проводит тепло, обладает хорошей теплоёмкостью и, что немаловажно, высокой температурой кипения. Одно дело, когда «закипит» жарким летом автомобиль, и совсем другое, когда это будет атомный реактор. Во-вторых, в отличие от воды, натрий слабо замедляет нейтроны, в результате активная зона реактора может эффективнее работать. И, наконец, от натрия не ржавеют трубы, и он не деградирует со временем, как различные органические вещества. Главное – не допускать, чтобы натрий вступил в контакт с водой!

На третьем энергоблоке Белоярской АЭС работает реактор на быстрых нейтронах с натриевым теплоносителем БН-600. Фото: Rosenergoatom/Flickr.com CC BY-NC-ND 2.0
Если вы захотите отыскать месторождение металлического натрий, то придётся вас огорчить – таких мест на нашей планете нет. Объяснение этому очень простое – натрий моментально бы прореагировал с водой, а как известно, даже в самой засушливом месте на Земле, пустыне Атакама, иногда бывают дожди. Однако есть одно необычное местечко, где можно повстречать чистый натрий, правда, для этого придётся подняться высоко в небо. На высоте порядка 80-100 километров существует слой, состоящий из атомарного натрия, который туда попал из падающих на Землю метеоритов. Толщина этого слоя составляет около 5 километров, но если у вас появилась идея начать промышленную разработку натрия на небесах, то придётся вам всё-таки спуститься на земную твердь: содержание натрия там исчисляется тысячами атомов на кубический сантиметр. Для сравнения, если посчитать количество молекул в таком же объёме воды, то для записи этого числа потребуется 22 нуля. Тем не менее, даже такие небольшие количества натрия можно обнаружить с помощью лазерной спектроскопии.

Серебристые или мезосферные облака возникают на высоте 76-85 км и состоят из крошечных кристалликов льда. Фото: NASA/Wikimedia Commons PD
Когда мы поднимемся над Землёй ещё на три сотни километров выше, то сможем найти ещё одно необычное место, связанное с натрием, – Международную космическую станцию. Исследования влияния невесомости на человеческий организм выявили один неожиданный эффект. Оказалось, что у космонавтов, длительное время пребывающих на орбите, в коже и соединительных тканях накапливается натрий, причём не в виде ионов, а в связанной с белками форме. Кажется, что на фоне таких связанных с низкой гравитацией проблем, как снижение минеральной плотности костей и уменьшение объёма крови, натрий в коже – это не так и важно. Однако это показывает, насколько чутко человеческий организм реагирует на такие чуждые для нас условия, как космическое пространство.

Долгое пребывание в невесомости серьёзно сказывается на здоровье астронавтов. Фото: Steve Jurvetson/Flickr.com CC BY 2.0
Однако вернёмся от космических проблем к более приземлённым материям. Например, грядущая «электрификация» нашей жизни и всё большее использование электрических аккумуляторов ставит человечеству вопрос: а из чего делать эти аккумуляторы, которые будут стоять в транспорте, от самоката до грузовика? Пока что ничего лучше литий-ионной батареи мы придумать не смогли. Но одно дело, когда литиевые аккумуляторы используются в небольших гаджетах, и совсем другое, когда нужно будет переделывать весь автотранспорт под электротягу. В мире просто может не хватить запасов лития, и его цена взлетит до небес. Решением проблемы, как сделать ёмкий аккумулятор из доступных материалов, занята добрая часть мирового научного сообщества вот уже, наверное, не один десяток лет. Одно из таких направлений – замена лития на более дешёвый натрий. И хотя время от времени в научных журналах появляются сообщения об успешных натриевых аккумуляторах, до практической реализации подобных технологий ещё довольно далеко.

Без литиевых аккумуляторов невозможно представить ни один современный гаджет. Фото: Adafruit Industries/Flickr.com CC BY-NC-SA 2.0
С натрием связаны интересные эксперименты как химиков, так и физиков. Первые, к примеру, стремятся получить новые и необычные соединения, что в наше время совсем не просто, особенно если речь идёт о простых молекулах из нескольких атомов. Поэтому современным химикам приходится идти на весьма неординарные шаги. Взять хотя бы синтезированное недавно соединение натрия и самого инертного элемента из всей периодической таблицы – гелия. Чтобы натрий вступил в химическую реакцию с гелием, оба вещества поместили в алмазную наковальню. Это специальная конструкция, внутри которой можно создать экстремально высокие давления в миллионы раз больше, чем атмосферное. Только в таких условиях благородный газ гелий снизошёл до химической реакции, чего в обычных условиях не произошло бы никогда.

Детали алмазной наковальни. Фото: Dawn Harmer/SLAC CC BY-NC-SA 2.0
Физики тоже не отстают от химиков в деле «нарушения» знакомых нам ещё со школьной скамьи аксиом. Все мы знаем, что самое быстрое, что может быть во Вселенной, – это скорость света в вакууме. Ничто не может распространяться быстрее этой фундаментальной константы. При этом нет формального запрета на то, чтобы свет распространялся с меньшей скоростью в каких-нибудь прозрачных средах. Поэтому, если свет пропустить, скажем, через алмаз, то его скорость уменьшится почти в два с половиной раза, хотя для обычной жизни она так и останется чудовищно большой. Но существует ли такая среда, в которой свет снизил бы свою скорость до «земных» значений? Оказывается, что такое возможно! Уже в 1999 году физикам удалось замедлить свет до скорости в 17 метров в секунду – такой лучик света ещё смог бы убежать от самого быстрого бегуна на планете, но не от среднего велосипедиста. Правда, чтобы наблюдать этот эффект, исследователям пришлось пропускать лазерные импульсы сквозь сверххолодный газ из атомов натрия.

Свет с разной длиной волны по-разному преломляется стеклянной призмой, благодаря этому эффекту мы можем с лёгкостью наблюдать спектр солнечного света. Фото: Tim Brauhn/Flickr.com CC BY 2.0
Вот такой он, элемент под номером одиннадцать: даёт живым клеткам электричество, охлаждает горячие реакторы и даже останавливает свет!

